-
什么是SEND?
SEND是Standard for Exchange of Nonclinical Data(非临床数据交换标准),用于不同组织(包括委托方及其外包合作伙伴)之间的数据交换,同时用于美国食品药品监督管理局 (FDA) 和其他监管机构的递交。它提供了向监管机构递交非临床数据的标准格式。
-
SEND标准的创建和优势
SEND标准由临床数据交换标准协会 (CDISC) 于2002年创建,为了将研究数据列表模型 (SDTM) 用于非临床研究的递交。数据呈现的标准化,使得法规机构不再需要录入数据、能够使用现有可视化工具审阅标准化数据集,同时促进研究之间的分析和比较,不管数据来源于哪家委托方或研究机构,显著降低审阅时间,这样可以加速药物开发的进程,从而降低开发成本。
SEND标准要求的试验类型和日期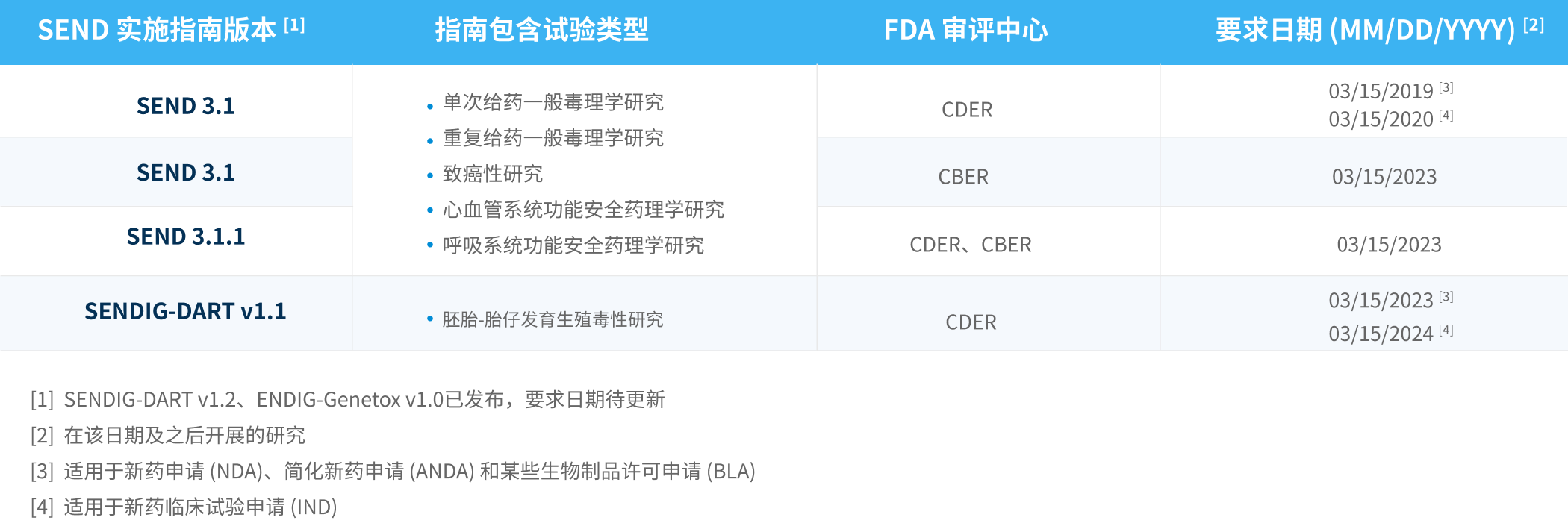 我们如何助力您的SEND递交?
我们如何助力您的SEND递交?我们将与委托方沟通电子通用技术文件 (eCTD) 递交需求和计划,包括需要递交的SEND数据信息,如SEND实施指南版本、SEND术语版本。在试验方案准备阶段,就做好SEND的安排和追踪。
我们应用前沿技术和软件进行数据的采集、管理和呈现,确保客户的数据符合美国FDA对SEND以及 21 CFR Part 11 的要求。我们在报告签署日期的 10 个工作日内提供 SEND 数据包,保持着可靠的行业标准领先水平。



