药明康德测试事业部赋能罕见病项目成功!
-
发布日期:2022-02-28
-
浏览量:0
-
发布者:
一、罕见病

2021年12月初,中国国家医保局公布了2021年医保新增的74种药物目录,包括7种罕见病用药,其中就有70万一针用于治疗脊髓性肌萎缩症(SMA)的诺西那生钠注射液,同时2021年11月份中国医保目录药品谈判现场的视频更是引起了广泛关注。罕见病及其研究现状也因此再次抓住医药研发界和全民的眼球。
罕见病是指发病率极低的一组疾病泛称,是一种相对的、动态的、变化的疾病,尤其随着人类对疾病研究的深入和诊疗技术的不断发展,越来越多的罕见病也逐渐被发现。全球已知的罕见病已经超过7000多种,仅不到10%的疾病现有已批准的治疗用药或者方案,且80%以上的罕见病属于遗传性疾病,95%的罕见病当前还无有效治疗的药物[1]。与此同时,每年大约有250种新疾病加入名单中。
罕见病具有如下特点:①大多数罕见病是严重的可危及生命,其中许多为先天性遗传性疾病,多始发于儿童期;②相比于常见疾病,罕见病通常缺乏流行病学和自然史数据,医疗信息不足,缺乏公认的研究终点及评价方法;③患病群体小、开展临床研究机会有限、药物研发经验少;④存在多种亚型,不同亚型患者的症状、体征、患病率及进展模式可能各有不同,患者可能呈现较高的异质性。
对于罕见病的定义不同国家也有不同的标准,如下表1所示列举了全球部分国家地区关于罕见病的界定:
表1 不同国家和地区的罕见病定义

全球预计有3亿名罕见病患者,由于中国人口基数大,罕见病在中国其实并不罕见,且每年新增患者超过20万。《罕见病诊疗指南(2019年版)》是首部关于罕见病的诊疗指南,涵盖121种罕见病,体现了中国罕见病诊断、鉴别诊断和治疗的科学性、权威性、规范性、代表性、实用性和指导性[2]。
目前,国际上并没有专门的、特殊的、针对罕见病的分类标准。Orphanet作为全球罕见病权威网站,根据世界专家对罕见病按照ICD编码原则进行初分类,包含32种类型涉及4952种疾病。中国医生对罕见病分类则是通过检索CNKI文献库和对应科室进行了整理和分类[3],大致分为:脑部和神经类、心脏、呼吸循环系统、骨骼、代谢异常、免疫以及其他或者分类不明确的。
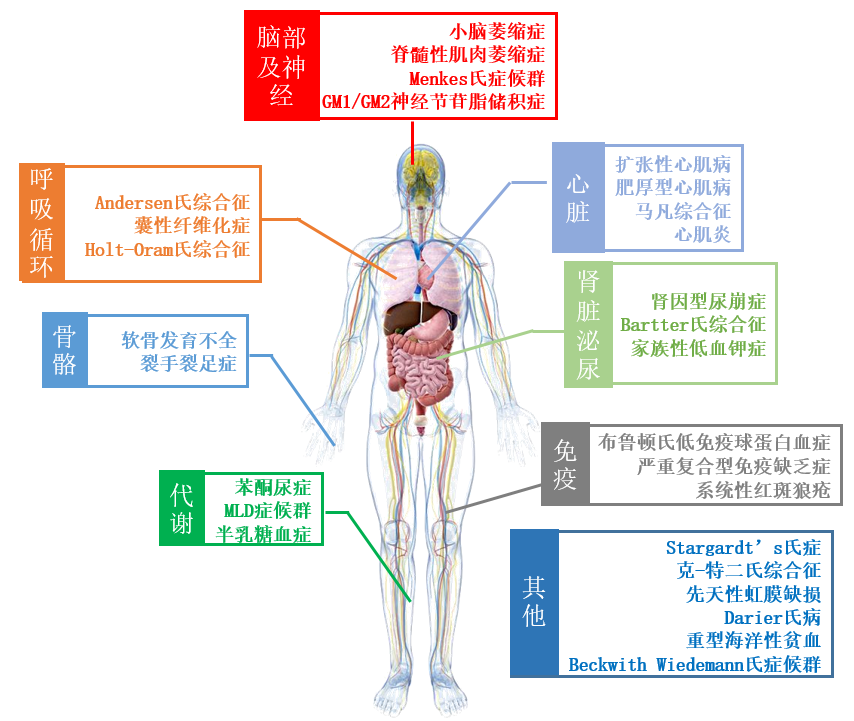
图1 罕见病疾病初分类
二、罕见病研究现状
中国由于对罕见病研究起步较晚,罕见病信息传播、关注度以及临床诊断的准确度、药物研发也都存在较大困难。医药研发领域罕见病的药物研发早期也是以传统的小分子药物居多,但随着分子生物学的进步和对人类基因组的理解扩大了药物发现工具,基于蛋白类(如重组蛋白、多肽、抗体类)、反义核苷酸(ASO)、小干扰RNA(siRNA)、基因治疗以及细胞治疗等不同类型的罕用药研发也纷纷获得了突破性进展。
不同类型的治疗方式则分别针对不同的靶点和药物作用机制。基于蛋白质的疗法能够调节细胞外靶点并替换功能失调的循环蛋白,而ASOs、siRNA和基因及细胞治疗拓宽了药物靶向空间,包括难以用小分子和蛋白质解决的靶点和机制,如转录因子靶点和功能失调的细胞内蛋白质的补偿[4]。总之,这些治疗方式允许广泛覆盖靶点和机制,可以通过组合方式(如小分子结合抗体)来扩展。表2中分别总结了不同罕用药物治疗的优缺点。
表2 不同罕用药治疗类型对比
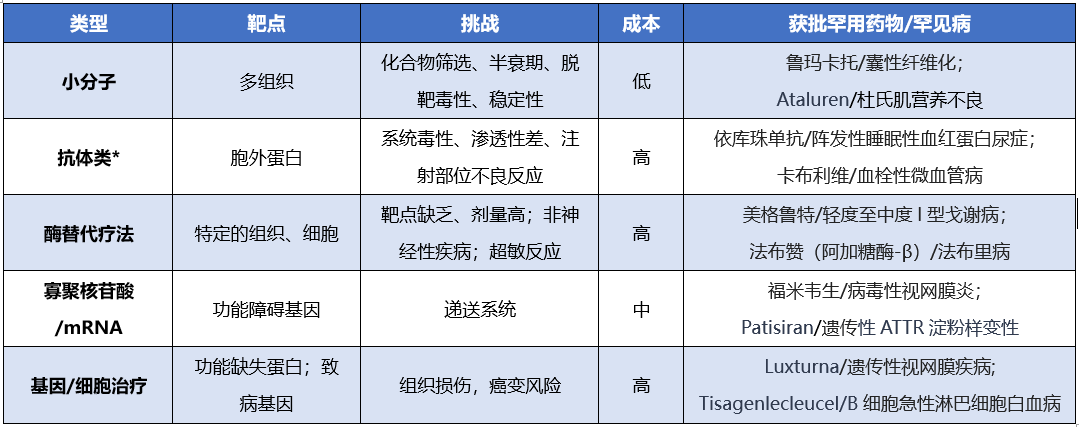
注:*抗体类包括单抗、双抗或者其他多抗、ADC
在研发成功率方面,根据FDA罕见病药物从I期临床到获得FDA批准上市的平均成均成功率为17.0%,高于整体药物的平均开发成功率7.9%,且罕见病药物四个开发阶段转化成功率均高于行业平均值。当前全球罕用药几乎被诺华、罗氏、新基等国际制药巨头占据,根据医药咨询公司LgeaHub报告,Top10企业占据了罕用药市场的54.9%。中国罕见病领域研发起步较晚,近年来,罕见病各种激励政策陆续出台,将会推动中国药企纷纷进行罕见病药物研发的布局,其中复星医药、奕安济世、北海康成、上海众强药业的研发管线中均包含了遗传病药物。
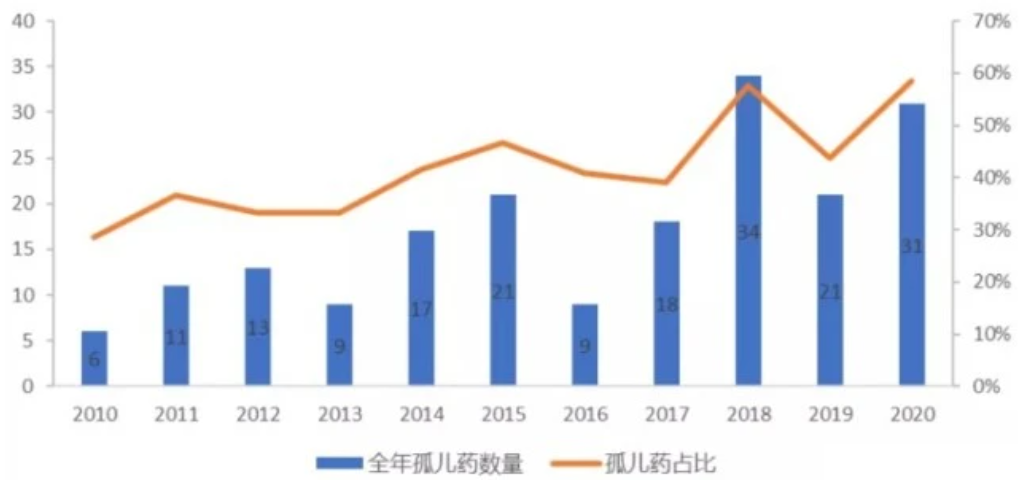
图2 FDA历年批准罕用药数量趋势
(2010~2020)
罕见病的临床研究和入组都面临极大挑战:首先,治疗靶点的研究受制于罕见病的发病机制研究不足、样本数量不足,临床研究的耗时更长和实验的终点设置困难;第二,患病人群少,导致临床实验的招募和入组比较困难。此外罕见病确诊难度高于常见病,并且药物推广到临床使用难度亦高于非罕见病药物,其中涉及到分子基因诊断的应用、诊断治疗指南的设立、专家库的建立、患者登记制度的设立和药品可及性等因素。
三、非临床安全性评价、临床、生物分析
目前,全球已纷纷出台了罕见病药物临床研发技术相关指导原则,而针对非临床的安全性评价阶段,尚且缺乏特异的指导原则,因此罕用药非临床安全性评价主要参考常规治疗用生物制品非临床安全性技术审评的一般原则。非临床研究的数据对于设计早期临床试验非常重要,特别是选用相关动物种属从而确定潜在的毒性靶器官和毒性反应性质、程度及可逆性,推测人体用药的安全起始剂量、计量递增方案、给药方式方案。药效学、一般毒理等试验方案设计中,一般会涉及到药代动力学/毒代动力学、包括免疫原性、潜在的免疫抑制和免疫刺激反应的免疫毒性等免疫毒理学多项指标[5-8]。其中如果所研发的罕用药物是基于基因和细胞治疗的,特别是病毒为载体的基因治疗,同时需要参考基因和细胞治疗相关指导原则增加生物分布、脱落、病毒抗体预筛选、中和抗体检测,以及抗原特异性的细胞免疫反应[9-12]。
药明康德测试事业部迄今已赋能多家客户不同类型罕用药新药研发IND工作并获得临床批件,以及多个正在进行中的罕用药非临床研究,包括酶替代疗法(重组蛋白)、寡聚核苷酸、基于病毒为载体的基因治疗等多种新型药物类型。其中生物分析团队支持完成的临床前分析工作的就有北海康成开发的CAN103。CAN103是一种用于成人和儿童I型和III型戈谢病患者的长期治疗的酶替代疗法,该药物已获得中国国家药品监督管理局(NMPA)新药临床试验申请(IND)的批准。
药明康德测试事业部-生物分析部集LC-MS/MS、LBA、PCR、细胞水平分析等多平台为一体,在生物分析领域有超10年的分析经验,特别是近几年,随着日趋复杂的不同modality的生物药的研发,药明康德生物分析部在LC-MS/MS分析分析生物药[13]、oligo及基于不同修饰的oligo,hyELISA/hyMSD分析oligo也分别建立健全了相关能力,同时,建立了PCR和数字化PCR平台的分析能力和自动化体系以及基于抗原特异性的细胞水平的免疫反应(ELISpot)相关能力[14-16],如图3所示全方位的生物分析能力为赋能客户各种modality药物研发治疗罕见病保驾护航。
 图3 多样化的分析平台
图3 多样化的分析平台
根据所研发的罕见药物modality类型的不同,其分析策略也有所不同,根据申报成功案例中涉及到的生物分析策略总结如表3所示。同时药明康德测试事业部-生物分析部已经全面建立相关技术平台和能力,期待不久的将来可以参与并赋能更多客户更多的罕用药的成功研发。
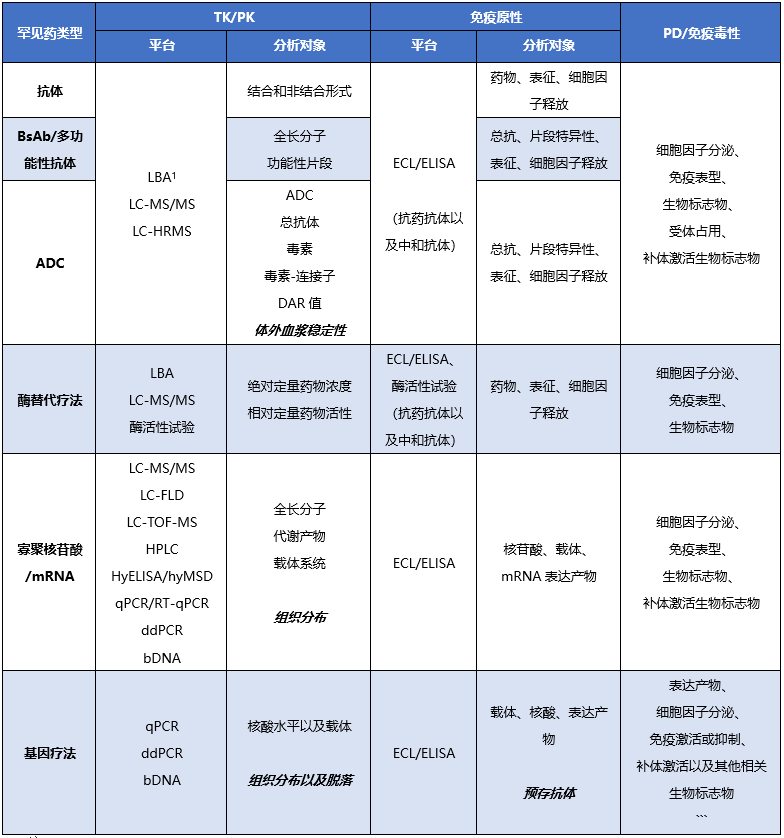
注:1.LBA: 配体结合实验ligand binding assay
四、罕见病治疗展望
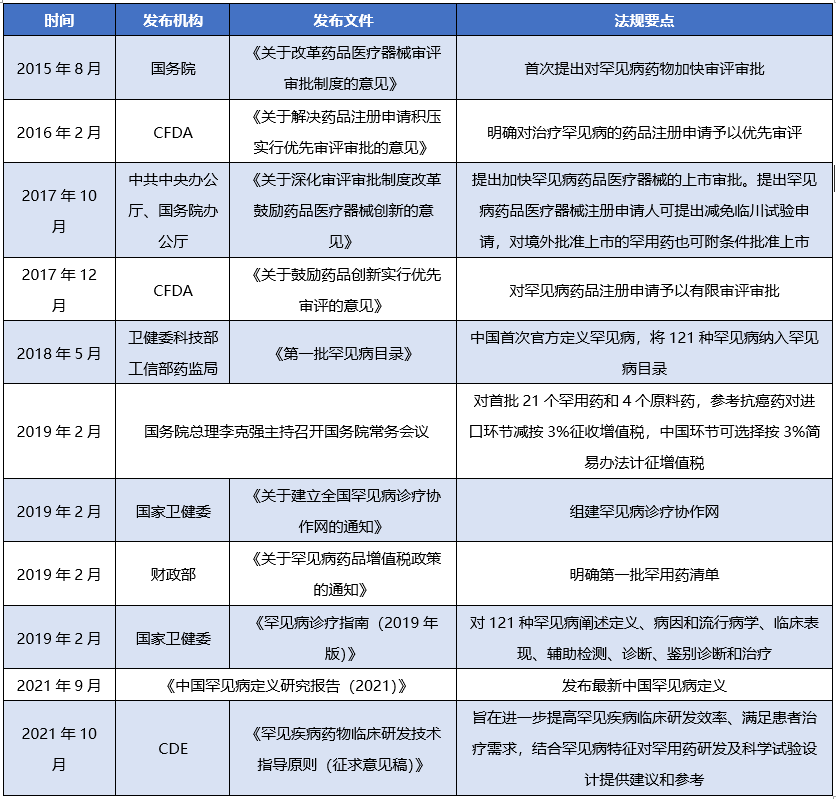
2021年随着《中国罕见病定义研究报告2021》报告中首次明确罕见病定义,及“新生儿发病率小于1/万、患病率小于1/万、患病人数小于14万的疾病”,为攻克罕见病,监管部门近年来高度重视罕见病药物的研发,出台了一系列法规文件,加速罕见病药物的审评审批,促进了药企积极参与罕见病药物的研发进度,“1+N”多方共同支付罕见病用药保障机制逐渐完善,中国罕见病治疗将得到越来越多的重视,将进一步推动中国罕见病患者用药保障,为罕见病患者带来福音[17],同时药明康德测试事业部生物分析团队健全的分析能力也将全面为医药界罕用药的研发赛道助力。
表4 罕见病药物研发相关政策
参考文献:
1.吕有标, 黄春芝, 张保寅,等. 中国罕见病研究现状及对策建议[J]. 中国药物经济学, 2021, 16(2):5
2.罕见病诊疗指南(2019年版)
3.谢冰洁, 蒋立新, 徐江平. 罕见病的初分类研究[J]. 生命科学仪器, 2018, 16(2):7
4.Tambuyzer E , Vandendriessche B , Austin C P , et al. Therapies for rare diseases: therapeutic modalities, progress and challenges ahead[J]. Nature Reviews Drug Discovery, 2019, 19(R2):1-19
5.NMPA: 罕见疾病药物临床研发技术指导原则(征求意见稿),2021
6.NMPA: 治疗用生物制品非临床安全性 技术审评一般原则,2007
7.ICH Harmonised Tripartite Guideline S6 (R1). Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals. June 2011
8.ICH Harmonised Tripartite Guideline S8. Immunotoxicity Studies for Human Pharmaceuticals. May 2020
9.NMPA: 基因治疗产品非临床研究与评价技术指导原则(试行),2021
10.ICH S12 Nonclinical Biodistribution Considerations For Gene Therapy Product, 2021
11.Guidance for Industry Preclinical Assessment of Investigational Cellular and Gene Therapy Products 2013
12.Design and Analysis of Shedding Studies for Virus or Bacteria Based Gene Therapy and Oncolytic Products Guidance for Industry 2015
13.Quantification of Human Coagulation Factor VIII in Monkey Plasma Using a Novel LC-MS/MS Method hybrided with Immunocapture. 2020 WRIB
14.Saletti, G. , et al. "Enzyme-linked immunospot assays for direct ex vivo measurement of vaccine-induced human humoral immune responses in blood." Nature Protocols 8.6 (2013):1073-1087
15.Janetzki, S., Price, L., Schroeder, H. et al. Guidelines for the automated evaluation of Elispot assays. Nat Protoc 10, 1098–1115 (2015)
16.Yang, F., Patton, K., Kasprzyk, T. et al. Validation of an IFN-gamma ELISpot assay to measure cellular immune responses against viral antigens in non-human primates. Gene Ther (2021)
17.GUI Yiting, LI Qiang, GUI Yonghao. Application and prospect of gene therapy for rare diseases [J]. Journal of Clinical Pediatrics, 2020, 38(10): 794
-药明康德测试事业部-