PCR技术在杜氏肌营养不良症药物研发中的应用
-
发布日期:2022-04-18
-
浏览量:0
-
发布者:LTD


杜氏肌营养不良症简称DMD(Duchenne Muscular Dystrophy),是一种X染色体隐性遗传疾病,为罕见的、不可逆的、致命的遗传性神经肌肉疾病,主要表现为一种严重的进行性肌肉萎缩症。DMD患者多为男性,2/3的患者家庭没有已知的疾病家族史。据报道,全球DMD的发病率为每10万名男婴10.7~27.8例[2]。杜氏肌营养不良患者遭受持续和不可逆的肌肉损伤,DMD患者一般在3-5岁开始发病,症状最早表现为进行性腿部肌无力,随着年龄的增长,一般在12岁左右丧失行走能力,在20岁-30岁时引发心脏衰竭和呼吸障碍而早夭[3]。
DMD多由Xp21染色体上的DMD基因突变引起,主要表现为DMD基因内缺失一个或多个外显子,从而破环了开放阅读框,导致抗肌萎缩蛋白(dystrophin)的缺失[1]。抗肌萎缩蛋白是一种肌膜相关的细胞骨架蛋白,对维持机体的稳定性和稳态至关重要。
外显子跳跃疗法是目前DMD的常用疗法,通过特定方式,如反义寡核苷酸(ASO)药物,通过序列特异地与靶基因DNA或mRNA结合而抑制基因表达,从而让表达抗肌萎缩蛋白的RNA前体在剪接时跳过特定外显子。DMD患者的基因突变会造成阅读框(readingframe)移动,生成没有功能的抗肌萎缩蛋白。而外显子跳跃疗法去除了基因突变带来的阅读框移动,生成的抗肌萎缩蛋白虽然比正常蛋白短,但是仍然具有部分抗肌萎缩蛋白功能。其中ASO外显子跳跃的原理图示如图1所示。
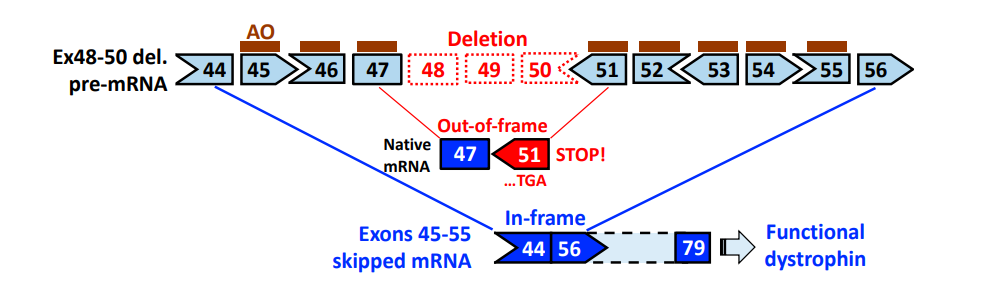
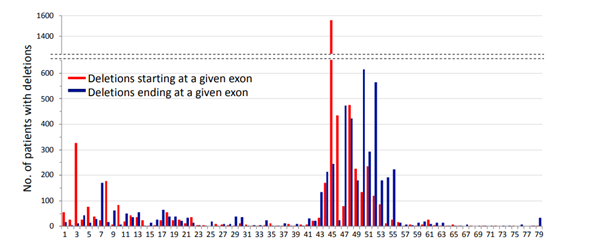
科学家们对不同外显子跳跃位点进行了深入研究,其中外显子1-22和43-55号是DMD外显子跳跃的两大研究热点区域(图1)[4]。
目前,有4款反义寡核苷酸疗法药物获得FDA批准,多款ASO药物处于临床研究阶段,如Sarepta公司的eteplirsen(51号外显子跳跃)已批准上市,golodirsen(53号外显子跳跃)、casimersen(54号外显子跳跃)等处于临床阶段[5]。如何准确地检测外显子跳跃效率,对DMD疗法的研究至关重要,本文将介绍不同PCR方法在检测外显子跳跃效率中的应用,以及药明康德生物分析部的平台能力。
ASO药物诱导外显子跳跃治疗效果的研究,需要对治疗前和治疗后的外显子跳跃水平进行定量分析和检测,PCR技术是检测外显子跳跃的常用方法和手段。随着PCR技术的发展以及药物研发日益增高的需求,外显子跳跃效率的检测方法也从1代RT-PCR,逐步发展到二代qPCR,以及三代ddPCR。
第一代检测方法是RT-PCR法,目前仍然是DMD细胞模型、肌肉组织实验等的主要方法。在目标跳跃的外显子上下游两侧设计上下游引物,发生外显子跳跃的PCR片段较未跳跃的更短,经过多轮PCR扩增后,使目的片段得到几百万倍放大,再通过凝胶电泳区分不同大小的条带。常用的一步法RT-PCR虽然操作步骤简单,但会有假阳性的可能。
经优化的巢式PCR通过设计两套PCR引物进行扩增,具有更高的特异性。然而,由于两种不同大小的片段同处一个反应体系,两种目标片段由于大小差异等导致PCR扩增效率不同导致检测到的外显子跳跃效率比实际高而有失准确性。
一步法RT-PCR和巢式PCR引物设计原理见图3和图4所示。为了进行跳跃效率的定量,通过引入标准曲线法定量跳跃效率。其基本流程为:首先针对于该跳跃位点设计特异性引物,再按照一定浓度比例混合跳跃以及未跳跃的RNA,经过PCR扩增以及电泳,获得跳跃效率,以检测的跳跃效率为横坐标,实际的跳跃效率为纵坐标绘制标准曲线,最后将样品的检测值代入标准曲线即可回算得到实际的跳跃效率。由于凝胶电泳检测只是一种半定量方法,该方法测得的外显子跳跃效率无法进行准确定量[8-9]。
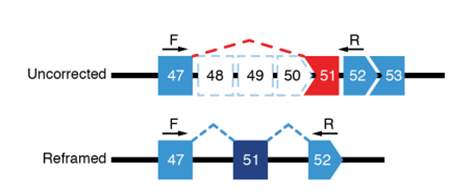
图3.一步法PCR引物设计位点6
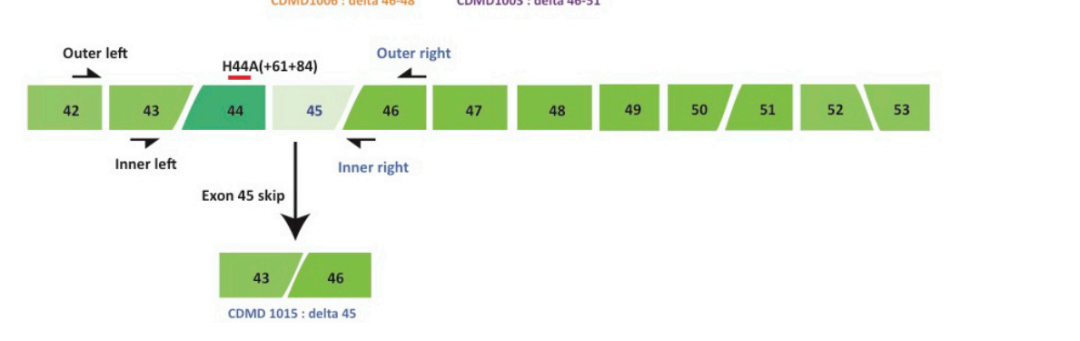
在二代实时定量PCR(qPCR)方法中,采用SYBRgreen或Taqman探针方法更准确定量抗肌萎缩蛋白片段[10-11]。针对外显子跳跃和未跳跃分别设计引物,对于未跳跃序列,引物分别设计在跳跃和相邻外显子上,对于跳跃序列,引物设计在跳跃外显子相邻外显子序列上,探针跨越两个外显子,引物设计见图5所示。无论是否有外显子跳过,均可获得一定的Ct值。相比第一代RT-PCR,定量更准确。然而,当发生跳跃的片段循环数大于35(Ct>35)时,qPCR结果显示更低效率,结果可信度降低。同时,qPCR的绝对定量需要依靠标准曲线,其结果受扩增效率等的影响。
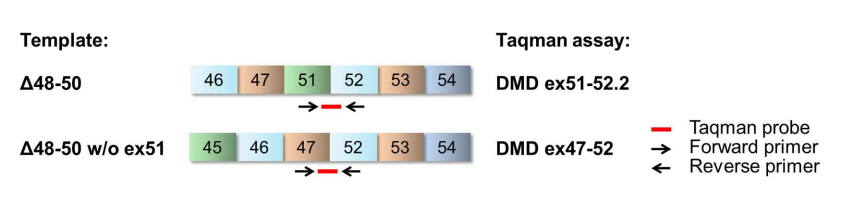
RT-PCR和qPCR需要依赖标准曲线进行定量分析,第三代微滴式数字PCR(Digital Droplet PCR,ddPCR)是一种无需借助标准曲线即可绝对定量的技术,该方法具有精密度高、灵敏度强和重现性好的特征。
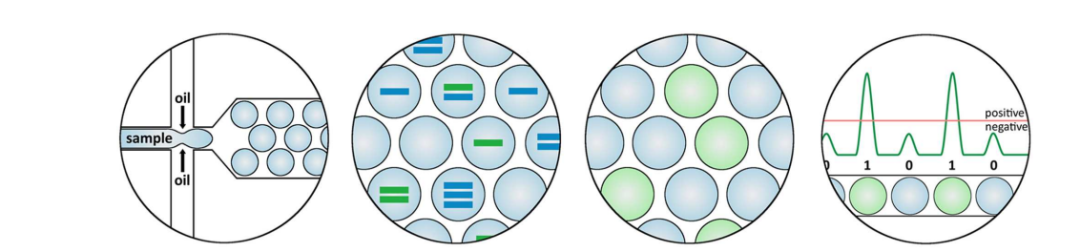
ddPCR原理(图6)如下:ddPCR仪将含有模板和PCR试剂的缓冲液分成由约2万油包水形态的液滴,模板分子被随机地分散在单个液滴上,呈现泊松分布,每个液滴包含的模板量为0或1,每一液滴进行独立的PCR循环后,得到阳性荧光值个数为定量的模板分子数。ddPCR的引物探针设计同qPCR(图4)。与前两种方法相比,ddPCR可以精确测定是否发生外显子跳跃片段的绝对拷贝数,从而精确计算外显子跳跃效率[9]。
药明康德生物分析部搭建了极具竞争力的PCR分析平台,开发和验证了多个qPCR及ddPCR的生物分析方法,符合最新白皮书及文献要求,与国际接轨。该平台具有丰富的基因治疗药物分析经验和先进的检测设备,实验室引进多台PCR仪、荧光定量PCR仪、数字PCR仪、全自动核酸提取仪和全自动核酸分析仪等(见图7)。
药明康德生物分析部承接了大量的基因及细胞治疗产品的临床前和临床的安全性评价工作,包括基因治疗产品如腺病毒AAV类药物、siRNA、ASO等的组织分布,归巢、脱落以及药效学评价等;除了基因和细胞治疗相关药物的临床前和临床分析外,生物分析部PCR平台也承接了大量药物筛选,药物前期研发阶段的PCR检测工作,如基因表达分析,基因分型,药效学检测等,可以满足客户药物研发阶段的多种不同实验需求。

图7.药明康德生物分析部PCR仪器
药明康德生物分析部引进了一系列的PCR自动化设备,包括全自动核酸提取仪,自动体系构建仪器,自动液体工作站,全自动核酸片段分析仪和自动微滴发生器等,其中qPCR仪不仅配备了96孔模块,同时配备了384孔模块,能够根据实验需求,为客户选择最优最经济的检测方法和方式。在多种自动化设备和多种仪器设备/模块的助力下,保证了实验室工作的高通量,高效率和高质量。
药明康德生物分析部PCR实验室参考临床基因扩增检验实验室的建设标准,将PCR实验室分成4个单独的工作区域:试剂贮存和准备区、样本制备区、扩增区和扩增产物分析区,同时通过实验室的送风排风系统的控制实现不同区域的压差。PCR实验室的规范建设减少PCR实验室常的交叉污染问题,保证实验结果的准确性和可靠性。
药明康德测试事业部生物分析一站式服务平台旨在为全球客户提供全面的,专业的生物分析解决方案。药明康德生物分析部恪守全球最高质量监管标准,是符合GLP法规的检测机构,已多次通过国家药品监督管理局(NMPA)、美国食品药品管理局(FDA)、经济合作与发展组织(OECD)、欧洲药品管理局(EMA)、日本医药品医疗器械综合机构(PMDA)的全面核查。本部门拥有完善的大、小分子分析平台,为客户提供全方位的药物研发生物检测服务,拥有包括寡核苷酸、细胞基因治疗、双特异性抗体等新型药物形态的生物分析能力对于加速全球客户的新药研发进程、助力全球医药行业发展具有非常特殊意义。