助力卸下“甜蜜的负担”
-
发布日期:2022-05-10
-
浏览量:0
-
发布者:LTD


糖尿病是一种历史悠久的疾病。人类对于糖尿病的研究,几乎伴随了东西方医学发展史。早在公元前1500年的古埃及,医学古籍中对于糖尿病就有了记载,人们观察到患者会出现饮水增加,纷繁小便的情况,同时伴随着极度干渴和体重降低。中国古代将糖尿病称为“消渴”,它首次出现于《素问》,描述为“有并口甘者……此人必数食甘美而多肥也……转为消渴”。而现在糖尿病的英文临床术语diabetes mellitus(DM),则可以追溯至古希腊。Diabetes意为to pass through,引申为多尿;而mellitus是拉丁文“甜蜜的”的意思[1]。无论中西,都把“排泄含有糖分的尿液”作为这种疾病的主要特征,但是这种以糖为名的疾病,带给患者的却远非甜蜜,而是漫长的苦涩。
现代医学中,根据患者是否存在胰岛素(Insulin)分泌缺陷,将糖尿病分为I型糖尿病(TIDM)和II型糖尿病(TIIDM)。I型糖尿病的特征是分泌胰岛素的胰岛β细胞遭到破坏,大多发生于儿童和青少年时期;II型糖尿病则体现为胰岛素水平和胰岛素敏感性之间的失衡,由此导致持续性的高血糖,主要存在于中老年人群。全球范围内,糖尿病患者中90%为II型,无论TIDM还是TIIDM,如果患者没有采用适当的医疗手段对高血糖状态进行管理,将可能面临失明、肾衰竭、截肢等一系列严重后果[1] 。
I型糖尿病主要采用持续注射胰岛素来维持治疗。而II型糖尿病的患者,相对而言有更多的选择,很多传统的小分子药物有助于控制血糖水平,例如格列本脲、二甲双胍和阿卡波糖等等,主要作用机理在于增加胰岛素释放、增加胰岛素的敏感性或减少饮食摄入的糖分等[2]。而近年来,随着对胰岛和胰岛素研究的深入,糖尿病药物开发有了新的思路——GLP-1受体及其激动剂。
除了分泌胰岛素的胰岛β细胞,胰腺中还存在分泌胰高血糖素(Glucagon)的胰岛α细胞,顾名思义,胰高血糖素可以迅速升高体内的血糖水平。正常情况下,胰高血糖素-胰岛素存在相互制约又平衡的关系,可以帮助维持人体内的血糖在一个适当范围内保持稳定。1986年,Drucker等人在研究合成胰高血糖素的原基因序列(Preproglucagon Gene, GCG)时,得到意外的收获[3]。人体内合成胰高血糖素时,首先由GCG编译合成一条称为“胰高血糖素原(Proglucagon)”的多肽,这段肽链在不同的地方切断,可以产生多种不同生理活性的小肽段,其中之一将成为胰高血糖素。然而,就像一串长而美丽的宝石项链,被截为几段后能够成为手链、耳坠、戒指等等不同的装饰品,胰高血糖素原被截断后也会生成多种产物(图1)。这些产物中,有一段结构引起了Drucker等人的注意,他们将其命名为胰高血糖素样肽-1(Glucagon-like-peptide 1,GLP-1)。虽然GLP-1与胰高血糖素同根同源,但作用效果却截然相反,GLP-1能够促进体内胰岛素的释放,从而降低血糖。
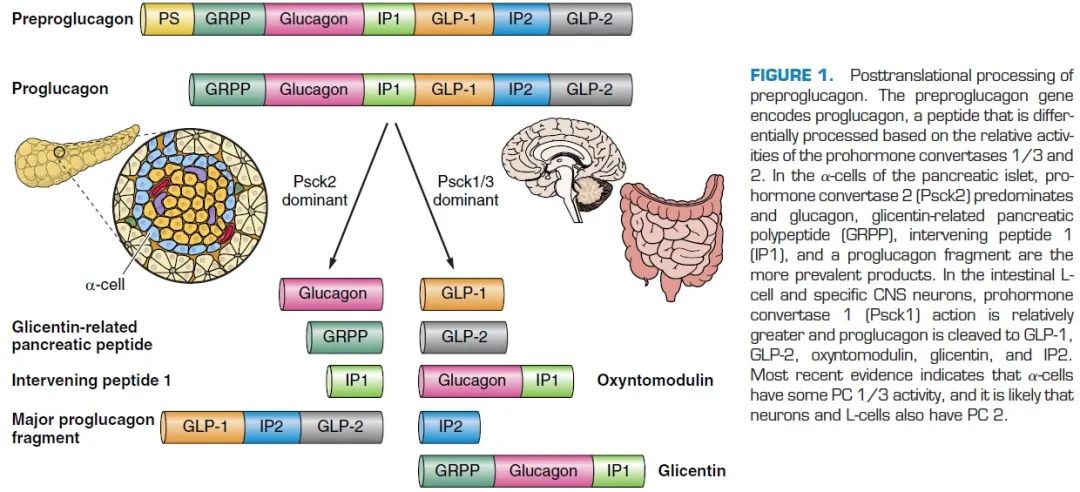
图 1. 胰高血糖素原基因的翻译后加工。胰高血糖素原基因编码胰高血糖素前体。在胰岛的α细胞中,激素原转化酶 2 (Psck2) 占主导地位,胰高血糖素、glicentin 相关的胰腺多肽 (GRPP)、介入肽 1 (IP1) 和胰高血糖素前体片段是更普遍的产物。在肠 L cell 和特定的 CNS 神经元中,激素原转化酶 1 (Psck1) 的作用相对较大,胰高血糖素原被裂解为 GLP-1、GLP-2、胃泌酸调节素、glicentin 和 IP2[4]。
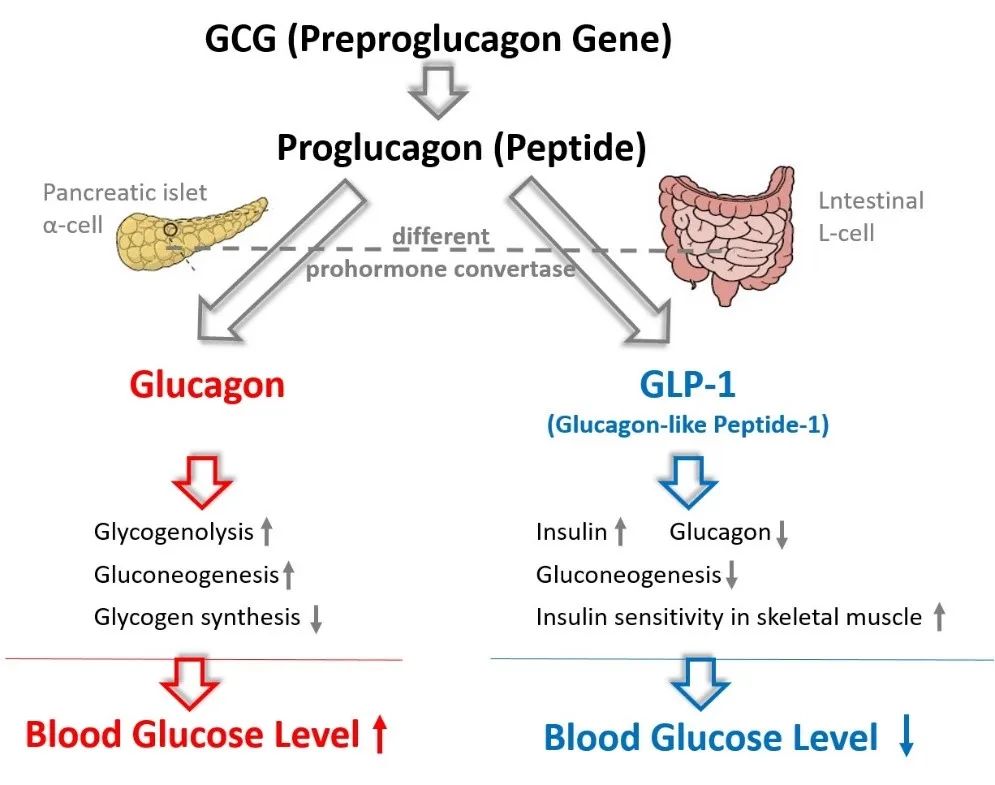
图 2. 胰高血糖素和胰高血糖素样肽-1对血糖调节的生理作用
GLP-1一经报道,就引起了药物研发者的极大兴趣,它非常有潜力被开发为一种新型的降血糖药物。进一步的研究也证明了这一点,与传统小分子降血糖药相比,将GLP-1修饰改性后制成的多肽类药物,刺激胰岛素分泌的作用是具有血糖浓度依赖性的。对于磺脲类药物不能有效控制的TIIDM患者,持续静脉输注GLP-1后,能够显著降低血糖;但当血糖达到正常水平后,继续注射GLP-1并未继续刺激胰岛素分泌,血糖仍然可以呈现稳定的状态[5]。因此在调节血糖的同时,GLP-1类似物药物引起低血糖的风险很低,这对于使用者而言更为安全。此外,GLP-1还可能具有减轻体重和改善胰岛β细胞功能的作用,可以对TIIDM患者的代谢异常进行多方面的调控[6]。
GLP-1类似物药物成为治疗TIIDM相关疾病的研究热点。在北美临床试验注册中心(clinicaltrials.gov)中检索GLP-1,能查看到约2600条临床研究信息。目前已经获得批准上市的GLP-1类似物药物包括Exenatide(艾塞那肽),Liraglutide(利拉鲁肽),Semaglutide(司美格鲁肽),Dulaglutide(度拉糖肽)等,其中司美格鲁肽(Semaglutide)成为首个可以口服的GLP-1降糖药;艾塞那肽,利拉鲁肽,度拉糖肽,贝那鲁肽,洛塞那肽和司美格鲁肽注射液已经在中国成功获批。与此同时,中国众多生物医药公司也在开发GLP-1类似物药物,我们期待在未来的几年中,有更多的中国产GLP-1类似物药物获批[7]。
对于GLP-1类似物药物临床PK样品的生物分析,与其他多肽/蛋白质药物相似,常规有配体结合法(LBA)和液相色谱-质谱联用(LC-MS/MS)两种方法,这两种方法各有特点,如表1所示。对于不同的临床试验方案设计,可以选择适当的分析方法,获得受试者血液中的药物浓度信息。
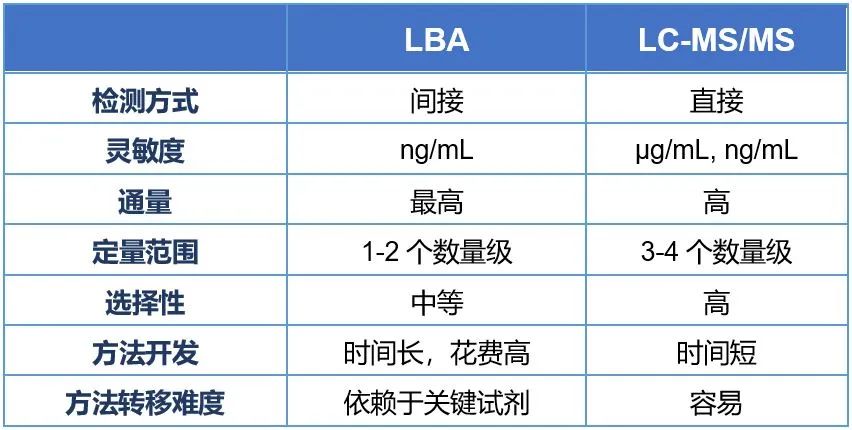
表1. LBA和LC-MS/MS平台检测多肽类化合物生物样品的特点比较
LC-MS/MS法支持GLP-1类似物药物的PK研究。由于GLP-1类似物药物的分子量通常不大,LC-MS/MS法选择性高,线性范围宽,容易在不同实验室间转移等特点,使之广泛应用于GLP-1类似物药物的生物分析中,适合于全球联合申报的临床研究。目前随着GLP-1类似物药物临床研究增多,LC-MS/MS平台进行PK研究的生物分析方法日趋成熟。
使用LC-MS/MS平台定量检测人血液样品中GLP-1类似物药物主要存在两方面的难点。首先,相比于小分子化学药物的LC-MS/MS生物分析方法,多肽/蛋白质类药物的样品前处理过程往往更为复杂,可能需要联合使用蛋白沉淀(PPT)和固相萃取(SPE)等操作,必要时,为了提高选择性,还需要使用免疫捕获的方法进行吸附和纯化。复杂的前处理过程对生物分析实验室提出了更高的要求,使这类项目非常依赖于方法高重现性,人员的操作熟练度和实验室既往的经验积累(图3)。
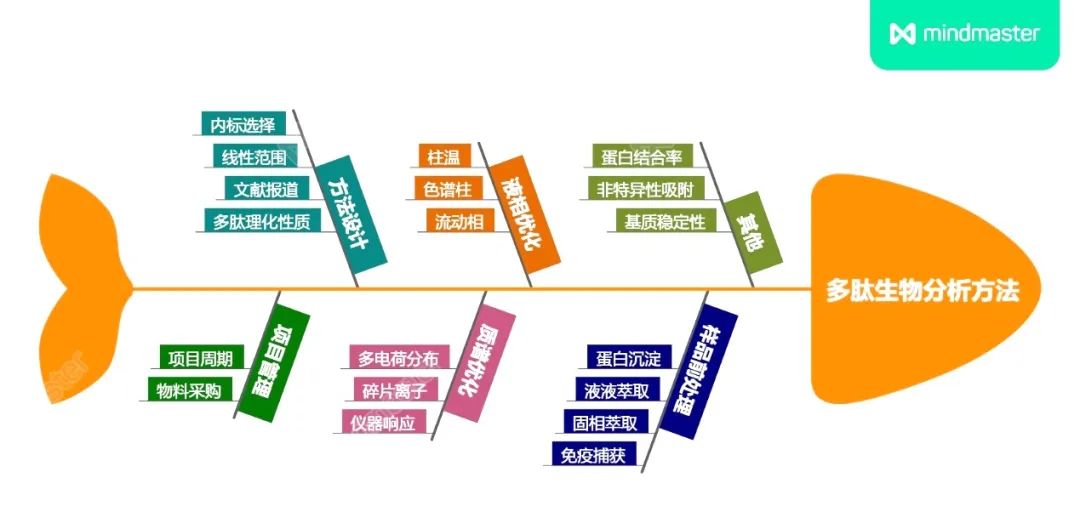
图3. 开发重现性好的多肽生物分析方法需考虑的方面
其次,很多GLP-1类似物药物的结构经过修饰。天然的GLP-1易被酶降解,有效半衰期仅为2-5 min,无法作为药物直接使用。然而糖尿病治疗目的又要求这类药物拥有尽可能长的作用时间,因此在药物开发过程中,必须要对GLP-1类似物多肽进行修饰和改造,除了氨基酸残基的替换之外,还增加了延长半衰期的结构。例如利拉鲁肽,是能抵抗二肽基肽酶IV(DPP IV)作用的GLP-1类似物,在GLP-1的赖氨酸残基上加上16碳的酰基链,34位赖氨酸由精氨酸取代,从而在血浆中与血清白蛋白结合,增强缓释效果[8]。
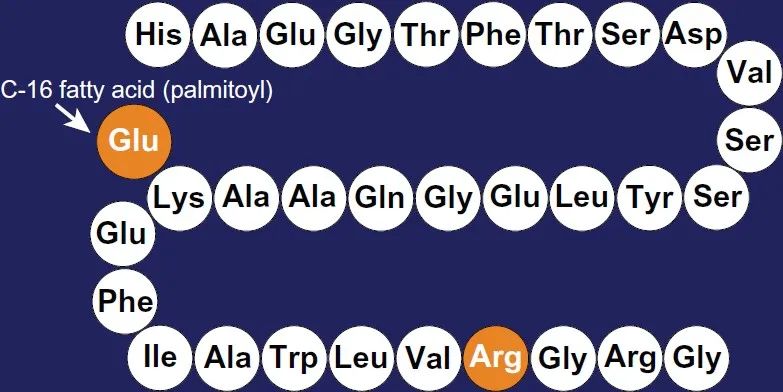
图4. 利拉鲁肽的结构式
烷烃长链的加入(图4),会使这类药物比一般的多肽/蛋白质类药物更“粘”,极其容易在LC-MS/MS系统中造成吸附和残留。因此GLP-1类似物的LC-MS/MS方法也具有特殊之处。
LBA法支持GLP-1类似物药物PK研究。由于分子大小的原因,相比于LC-MS/MS方法,LBA法往往难以应用在GLP-1类似物药物的PK研究中。但若在获得特异性抗体的情况下,则可能开发出相应的LBA方法。下图5是基于MSD平台,开发出的关于人血浆中定量检测艾塞那肽的LBA法举例。这是一个典型的双抗夹心法,使用生物素标记抗GLP-1特异性抗体作为包被抗体包被96孔MSD板,使用金属钌标记的抗GLP-1特异性抗体作为检测抗体。为排除干扰,提高选择性,样品上样前需要经过PEG溶液提取。相比于LC-MS/MS方法,LBA法方法开发往往耗时更久,但通常具有更高的灵敏度,若可获得高特异性抗体,其检测限甚至能达到pg/mL级别,此外,通量高也让LBA在临床PK研究中具有广泛的优势。
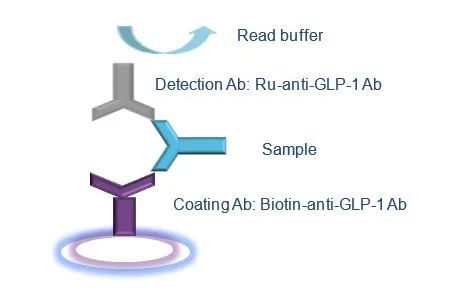
图5. 一个基于MSD平台的LBA方法示例
科学家还发现,将GLP-1多肽链连接上Fc-融合蛋白片段能进一步提高半衰期,这便产生了度拉糖肽[9]。相比利拉鲁肽,多了Fc-融合蛋白结构的度拉糖肽,分子量大大增加,能达到近60KDa,能有效避免溶酶体的降解,大幅延长半衰期。针对此类药物,分子量较大,间接的LBA法在临床PK检测上就显示出其优势。
跟其他生物制剂一样,患者接受GLP-1类似物药物治疗后,体内可能会产生相应的抗药抗体(ADA)。考虑到免疫原性跟药物的有效性和安全性高度相关,药监部门要求对所有生物药都要进行免疫原性的评估和检测。GLP-1类似物药物的免疫原性检测,主要有电化学发光法(MSD),放射免疫分析法(RIA)等。
MSD平台的桥联(Bridging Assay)法免疫原性检测。MSD法(图6),具有灵敏度高、有效线性范围宽、均一性、重复性高、基质效应小、稳定好、检测通量高等特点,广泛用于GLP-1类似物药物的免疫原性检测。
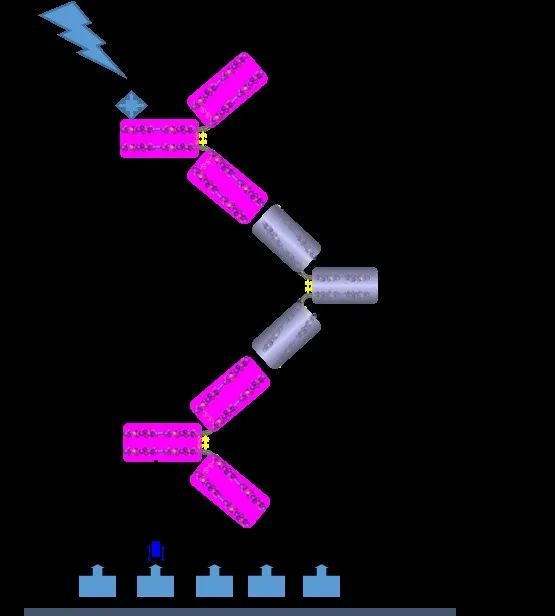
图6. MSD平台的桥联(Bridging Assay)法
GLP-1类似物药物分子量较小,Biotin标记和钌标记效率低于分子量大的药物,在方法开发阶段,需要根据药物特点,选择操作复杂、标记效率更高的透析膜法或直接化学合成方法标记药物。
如果GLP-1类似物药物作为生物类似药进行申报,还需要与原研药物进行一致性评价,比较阈值评估,药物耐受度等参数,考察内容的全面性与完整性依托于对指导原则的深入解读和核查经验的积累。
放射免疫分析法(RIA),是利用标记抗原和非标记抗原竞争结合其特异抗体,给予充分的时间,使反应达到平衡,然后分离,并分别使用自动伽马计数器(图7)测定结合的抗原抗体复合物放射性(B)和游离抗原放射性(F),来计算出非标记抗原含量的一种超微量分析技术。

图7. 自动伽马计数器
RIA法具有灵敏度高、特异性强、精确度和稳定度好等特点。如GLP-1类似物药物司美格鲁肽等,采用经典的放射免疫配体结合方法RIA,进行免疫原性检测,更能满足临床研究的全球联合申报对方法一致性的需求。
实验室安全级别、实验装备和人员要求高是RIA平台的特点。实验室需要满足国家及地方环评认可,实验人员在符合体检要求前提下,考取放免实验的上岗资格证后才能参与放免项目。参与放免实验,实验人员需全程穿着铅服,佩戴铅头套等防护装备,对实验人员的体能也是挑战。此外,同位素标记药物需要特定供应商定制,成本相对较高。
药明康德生物分析部拥有独立的放免实验室,完善的放射性实验室管理制度,组建了专门的放免团队,在过去10年时间内支持了多个全球客户的放免检测项目,积攒了丰富的方法开发、验证、样品分析项目经验。
药明康德生物分析部(BAS)成立于2005年,拥有先进的仪器平台,能提供以临床分析检测为核心的一体化服务。成立以来,服务了众多全球客户,对于行业法规有深刻的理解,在生物分析领域积累了非常丰富的方法开发,验证和临床样品检测的经验。依托药明康德一体化药物研究平台,我们对多肽/蛋白质类分子形态的性质有着深入的认识,目前BAS参与支持过多个GLP-1类似物药物的临床研究,艾塞那肽,利拉鲁肽,度拉糖肽,司美格鲁肽等各种GLP-1类似物药物。我们有熟练的实验人员,成熟的方法开发,验证和样品分析经验,稳定性同位素内标的合成,抗体的制备,以及丰富的应对NMPA/FDA/OECD等法规部门审计的经验,能够在技术和法规层面向客户提供强有力的支持。
药明康德生物分析部期待可以通过努力,为GLP-1类似物药物开发提供分析检测支持,希望更多的GLP-1类似物药物成功获批,造福于广大糖尿病患者,让他们能够卸下“甜蜜的负担”。
[1] Amit Sapra, Priyanka Bhandari, Diabetes Mellitus, StatPearls [Internet] or Treasure Island (FL). StatPearls Publishing; 2022
[2] 尤启东主编, 药物化学(第8版), 人民卫生出版社:北京, 2016
[3] Drucker DJ. Glucagon-like peptides:regulators of cell proliferation, differentiation and apoptosis [J]. Mol Endocrinol, 2003, 17(2): 161-171.
[4] D. Sandoval, D. D’Alessio, et al. Physiology of proglucagon peptides: role of glucagon and GLP-1 in health and disease. Biology, Medicine, Physiological reviews, 2015, 95: 513-548.
[5] Nauck MA, Kleine N, Orskov C, et al. Normalization of fasting hyperglycaemia by exogenous glucagon-like peptide 1 (7-36 amide) in type 2 (non-insulin-dependent)diabetic patients [J]. Diabetologia, 1993, 36: 741-744
[6] 中华医学会糖尿病学分会, 基于胰高血糖素样肽1降糖药物的临床应用共识[J]. 中华糖尿病杂志, 2014, 6:14-20
[7]https://clinicaltrials.gov/ct2/resultscond=&term=IBI362&cntry=&state=&city=&dist=
[8] Estela Wajcberg, Amatur Amarah, et al.Liraglutide in the management of type 2 diabetes. Drug Design, Development and Therapy 2010:4 279–290
[9] https://pi.lilly.com/us/trulicity-uspi.pdf