ADC药物的临床生物分析策略和挑战
-
发布日期:2024-09-06
-
浏览量:0
-
发布者:

*Blenrep于2022年11月22日从FDA撤回。
表1:FDA批准的ADC药物
ADC的结构由三部分组成:单克隆抗体(Antibody)、连接子(Linker)和细胞毒药物(Cytotoxic drug/Payload)。单克隆抗体负责靶向特定的癌细胞表面抗原,确保药物能够准确到达癌细胞。连接子是将抗体和细胞毒药物连接起来的化学桥梁。细胞毒药物则是通过破坏癌细胞的DNA或阻碍其分裂等方式实现杀伤效果[7]。
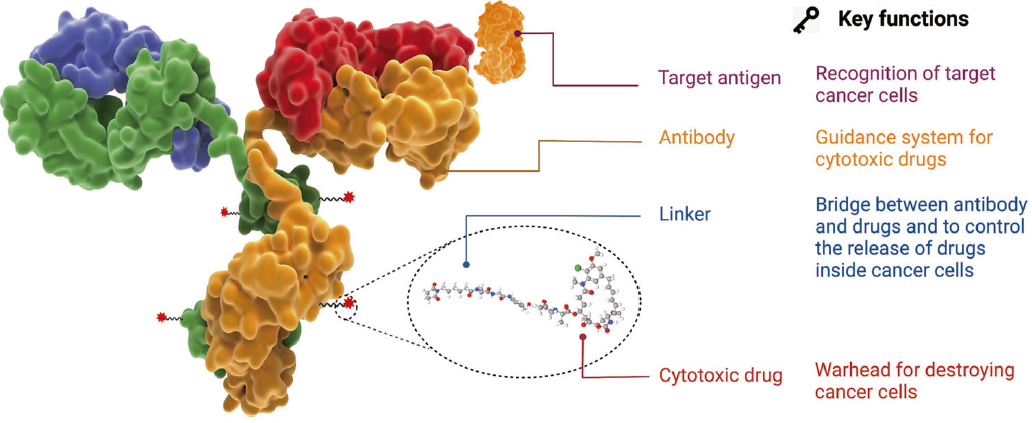
图1 ADC药物结构与特性[8]
ADC就像精确制导的“生物导弹”,能够准确摧毁癌细胞,提高治疗窗口并减少非靶向副作用。ADC的主要作用机制如图2所示,一旦ADC的单克隆抗体(mAb)与特异性表达于癌细胞表面的靶抗原结合,ADC被细胞内吞形成早期内体,随后成熟为晚期内体,最终与溶酶体融合。细胞毒性载荷最终通过化学或酶介导的方式在溶酶体中释放,导致细胞凋亡或通过靶向DNA或微管而死亡。当释放的载荷是可透膜或跨膜的,它还可能通过旁观者效应增强ADC的疗效。此外,这些药物的旁观者效应还可能改变肿瘤微环境,进而可能进一步增强ADC的杀伤效果[8]。
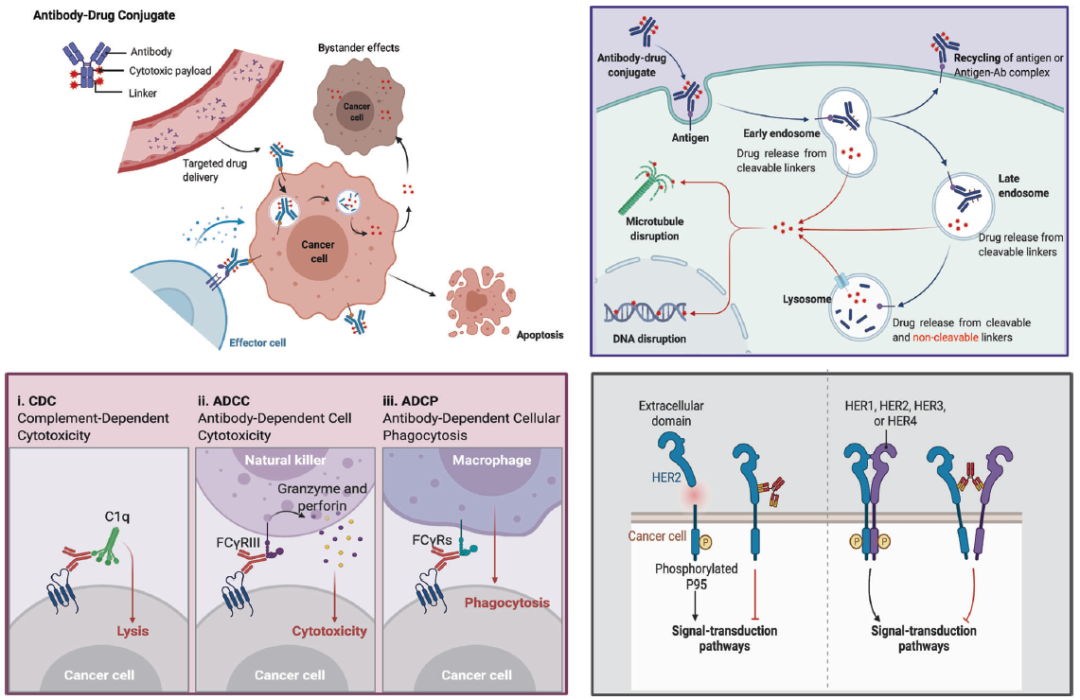
图2 ADC作用机制[8]
尽管ADC在多种癌症类型的治疗中取得了显著成功,但其在治疗难治性癌症中的潜力常常受限于肿瘤异质性和耐药性等因素[9]。通过改进ADC的设计,包括优化抗体、连接子和载荷,以及识别肿瘤特异性靶抗原和有效的生物标志物,涌现出了许多新型ADC药物。包括像双特异性抗体偶联药物,Probody偶联药物,免疫刺激抗体偶联物(ISACs),双药ADC[10]等等。每种ADC都提供了应对这些各种挑战的独特能力,为癌症患者提供更多更好的治疗选择。
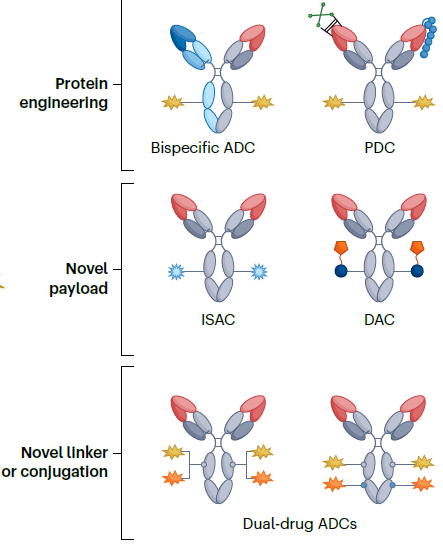
图3新型ADC药物[9]
ADC药物结构复杂,每个不同的组份,包括像抗体的结构,作用的靶点,药物连接的载荷,链接子,药物抗体比等等,都会影响药物的疗效和在人体的给药策略。了解这些药物临床研发阶段的药代和药效特征,以及免疫原性和安全性,可以对ADC在体内的作用机制和生物过程进行准确和全面的评估,从而促进安全有效的ADC药物的开发。
ADC药物由于结构的复杂性,在体内会经历分解代谢和生物转化等过程,导致ADC药物在体内会存在多种形式的ADC分子和多个ADC药物的组成分子,包括偶联抗体、抗体偶联药物、总抗体、裸抗、游离的小分子payload以及payload相关的代谢产物等,需要建立多个不同的临床生物分析方法,一般ADC的主要临床生物分析包括药代动力学的检测,抗药抗体的检测,中和抗体的检测,生物标志物检测等。
ADC进入体内后,payload可通过酶解或者化学反应从主体结构上逐渐解离,主要包括偶联抗体、抗体偶联药物、总抗体、裸抗、游离的小分子payload以及payload相关的代谢产物等。他们在体内的浓度变化对解读ADC的PK药代动力学特点至关重要。ADC为抗体或抗体片段至少结合一个payload(抗体偶联比(Drug to antibody ratio,DAR)≥1);总抗体为未偶联和偶联至少一个payload分子的抗体的总和(DAR≥0);Payload为ADC裂解或被分解代谢后形成的游离的payload,在FDA于2022年2月发布的“Clinical Pharmacology Considerations for Antibody-Drug Conjugates”指导原则草案中指出,在对ADC药物进行生物分析时,应该测定多种生物分析物用于评估ADC暴露量,例如:体内的总抗体含量、ADC含量以及小分子payload部分和药理活性代谢产物的含量[11, 12]。目前已经上市的ADC药物的PK检测主要包括总抗体、ADC和小分子化合物部分。一般总抗体和ADC的检测主要在LBA平台开展,小分子化合物部分在LC-MS平台进行。不过,随着ADC药物结构越来越复杂,检测的需求,ADC药物也开始在LC-MS平台进行总抗体,抗体偶联药物以及小分子毒素的检测。
对于总抗体和ADC部分的检测,通常在LBA平台上进行检测,采用ELISA或MSD平台。针对总抗体,通常利用靶点或抗裸抗的特异性抗体作为捕获试剂进行包被,再选择酶标的抗裸抗特异性抗体或普抗作为检测抗体进行检测(图4)。针对ADC,通常利用抗payload特异性抗体作为捕获抗体进行包被,再选择酶标的抗裸抗特异性抗体、普抗或者靶点作为检测抗体进行检测(图4)。以已上市的ADC药物Enhertu为例,它的主体是抗Her2抗体,有效载荷为Dxd,该上市药物的PK检测中,总抗体和ADC的检测是在ECL平台进行的,总抗体的检测中分别使用anti-HER2 antibody的特异性单克隆抗体作为捕获试剂和检测试剂,而ADC的检测中使用抗小分子抗体anti-Dxd antibody作为捕获抗体,检测抗体则使用测的是anti-HER2 antibody的单克隆抗体。当下双特异性抗体偶联药物(Bispecific ADCs)较为火热,双异性抗体ADC可以同时靶向两个不同的抗原,他们能够识别并结合两个不同的肿瘤抗原或同一抗原的不同位点,从而提高肿瘤特异性和治疗效果。像双抗ADC类的PK总抗体和ADC的检测策略可以参考双抗药物或者单抗ADC的PK生物策略。
液相色谱-质谱联用技术(LC-MS/MS)由于具有高选择性和高灵敏度的特性,是分析检测生物基质样品中痕量游离小分子毒素PK检测的首选方式。LC-MS/MS平台并不仅限于游离的小分子细胞毒性药物的定量分析,当采用沉淀蛋白,免疫捕获及酶解或化学水解处理之后,LC-MS/MS平台可以用于定量生物样品中偶联在抗体上的小分子毒素(conjugated drug)和ADC抗体的特征肽段(Total antibody)。蛋白沉淀后,进行酶解或者化学水解,是同时检测两个成分相对简单的方式。对血浆样品先进行蛋白沉淀并离心,之后分离上清(supernatant)和蛋白沉淀部分(protein layer)。上清在经过了吹干、复溶和过滤等操作后,所得样品溶液进行LC-MS/MS分析,即可获得非偶联小分子及其代谢产物的血浆浓度。与此同时,对蛋白沉淀部分进行酶解处理,从而释放偶联在抗体上的小分子和表征总抗的特征肽段,之后新添加沉淀剂对水解样品进行提取,取其上清吹干、复溶和过滤之后,所得样品溶液亦使用LC-MS/MS定量分析,可得偶联小分子毒素和总抗的血浆浓度[13]。使用免疫捕获和酶切进行样品前处理,从而可用LC-MS/MS分别测定人血浆酶解所得的小分子总量和酶解所得的特征肽段,来表示血浆基质中ADC和抗体PK[14]。通过前两种途径,都可以实现用一个方法同时检测出ADC和总抗的浓度数据,不仅降低了项目成本,同时也能在某种程度上,避免DAR敏感的问题,提高数据的可靠性。免疫捕获和LC-MS/MS技术,结合了LBA和LC-MS/MS的优势,也被广泛的用于到了ADC各个成分的PK分析中了。
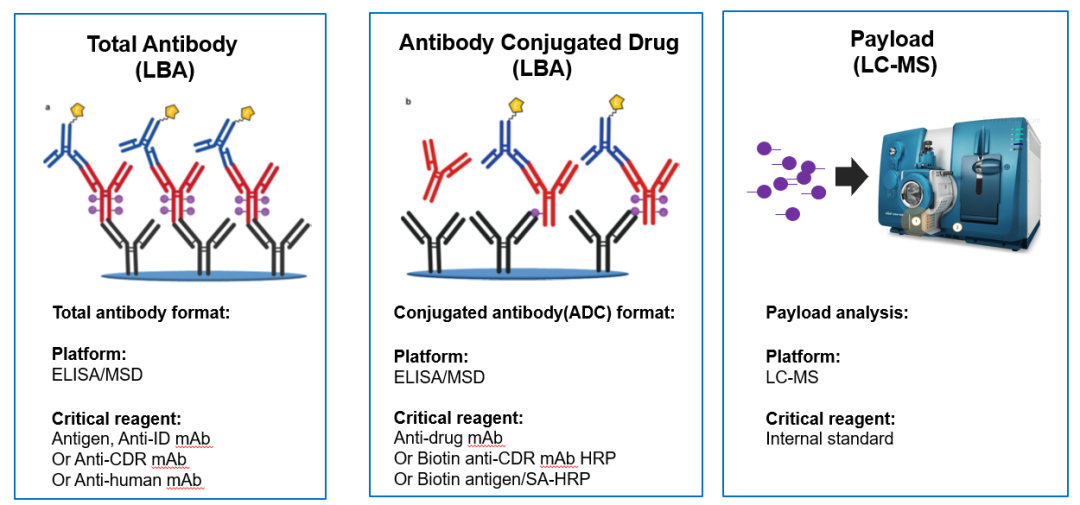
图4:ADC的PK生物分析[15]
由于ADC自身所具有的特殊结构和复杂的组分多样性,其PK生物分析方法的建立具有很大的挑战性,在LBA平台进行ADC的检测时主要有以下几个挑战:(1)DAR值敏感性,当ADC进入体内后,payload可通过酶解或者化学反应从主体结构上逐渐解离,产生不同DAR值的ADC药物,而ADC标准品往往不能准确的反应体内ADC药物的真实情况,尤其是PK靠后的一些采样时间点样本[16],另外不同DAR值的ADC药物与捕获试剂或者检测抗体的结合能力可能不同,影响总抗体和ADC浓度的准确度测定,尤其体现在一些高DAR值的ADC和低DAR值的ADC药物间。(2)小分子毒素结构的改变,目前在研的小分子毒素主要有DNA损伤剂、DNA转录抑制剂、微管蛋白抑制剂、美登素、喜树碱类、Tubulysin B类似物等,其化学结构可能会随着药物在体内的生物转化和分解代谢而发生改变,从而也带来它独特的生物分析挑战。例如,像喜树碱类的衍生物,作为DNA拓扑异构酶I的抑制剂,分子中的内酯环,是主要的活性基团,但结构不稳定,在pH上升时会打开,打开后的结构会改变和抗体之间的结合能力,从而影响PK的检测[17];另外有些小分子毒素在体内会发生转化,PK的检测形式也会增多,例如ADC药物MEDI4276,临床的PK检测包含了总抗体,小分子毒素转化前后的ADC,游离的转化前后的小分子毒素5种形式[18]。(3)可溶性靶点蛋白,当循环系统中有高浓度游离的可溶性靶点蛋白时,可能会影响抗原或者是特异性抗体和药物的结合效率,从而对PK的检测带来一定的影响。(4)抗药抗体,当体内有抗药抗体或者是中和抗体产生时,都会对PK的检测带来影响,抗药抗体可能会带来空间位阻的影响,而中和抗体会直接影响抗原或者特异性抗体和药物的结合。在LC-MS平台进行小分子毒素的检测时主要有以下几个挑战:(1)小分子毒素的血浆浓度通常比较低,方法的检测下限通常比较低,例如在一项对8种MMAE ADC的PK研究中,在单次静脉注射2.4 mg/kg的剂量之后,血浆中游离MMAE的浓度Cmax均比其相应的ADC及总抗体的浓度低至少100倍,仅为不到10 ng/mL[19]。这就意味着这类小分子基质样品的检测下限需要低至几百甚至几十pg/mL[13, 14](2)在对ADC小分子药物进行生物分析方法开发时,研究者除了要考虑小分子可能在不同温度、不同pH条件、或在基质中酶解而产生的不稳定性,也要考察在一定浓度的ADC存在的条件下,在基质样品中游离小分子的“稳定性”。而这后一种情况若存在不稳定性,则通常表现为游离小分子的浓度随时间增长或温度升高而升高,与小分子由于自身的不稳定性所导致的浓度下降刚好相反。这种导致小分子浓度升高的“不稳定性”与ADC连接子的性质相关,研究者可以根据连接子和小分子本身的性质提出应对的稳定性解决方案。例如:是否在样品中添加缓冲试剂以控制pH或抑酶剂,在哪个阶段添加(临床采样、第一次化冻或是样品提取后),样品提取时是否可置于室温或是必须浸于湿冰浴中,等等。这些稳定性考察实验包括且不限于全血稳定性、实验台(样品前处理)稳定性、储存稳定性、冻融稳定性和样品提取后的稳定性等。
跟其他生物制剂一样,患者接受ADC药物治疗后,体内可能会产生相应的抗药抗体(ADA)和中和抗体(NAb)。考虑到免疫原性跟药物的有效性和安全性高度相关,药监部门要求对所有生物药都要进行免疫原性的评估和检测。对于ADC的免疫原性分析,FDA发布的“Clinical Pharmacology Considerations for Antibody-Drug Conjugates”指导原则草案的免疫原性相关章节指出,ADC的任何组成部分都可能产生免疫应答,包括抗体、payload或由连接子产生的表位[20]。同时该指导原则草案[21]指出对于免疫原性的评估,应按照FDA指南“Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection” (2019年1月)[21]中概述的方法进行免疫原性评估,包括检测ADC抗药抗体(ADAs)的确认性评估。此外,应开发多种检测方法来测量对ADC组成部分的免疫反应,例如偶联产生的额外表位或结构域。对于多结构域蛋白的抗药抗体生物分析,2019年美国FDA发表的“Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection”和2021年国家药品监督管理局发布的《药物免疫原性研究技术指导原则》[22]均明确指出“对于多结构域治疗性蛋白药物,如聚乙二醇化蛋白、多特异性抗体,建议针对整个治疗性蛋白药物进行初步筛选试验和确证试验,基于风险或产品特征,对确证为阳性的样本进一步开展域特异性评价。”
ADC药物的抗药抗体(ADA)检测主要是基于MSD平台的桥联(Bridging Assay)法。如图5,生物素(Biotin)标记的ADC药物作为捕获试剂,钌标记的ADC药物作为检测试剂,该方法具有灵敏度高、有效线性范围宽、均一性、重复性高、基质效应小、稳定好、检测通量高等特点,广泛用于ADC药物的ADA检测。
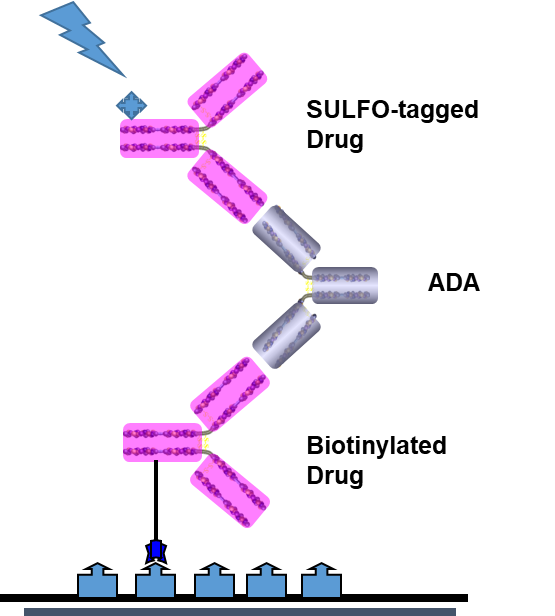
图5. MSD平台的桥联(Bridging Assay)法
ADC药物的ADA检测主要遵循分层级免疫原性分析策略,但由于独特的结构特征,不仅抗体部分可以引发免疫反应,连接子或小分子毒素部分虽然分子量比较小,免疫原性比较弱,但也有可能产生ADA。因此在检测ADC药物的ADA时,对ADC药物确证为阳性的样本根据需要进一步开展域特异性评价。双特异性抗体偶联药物(BsADCs)的结构更加复杂,根据结构特性可以做更多不同表位的特异性检测。
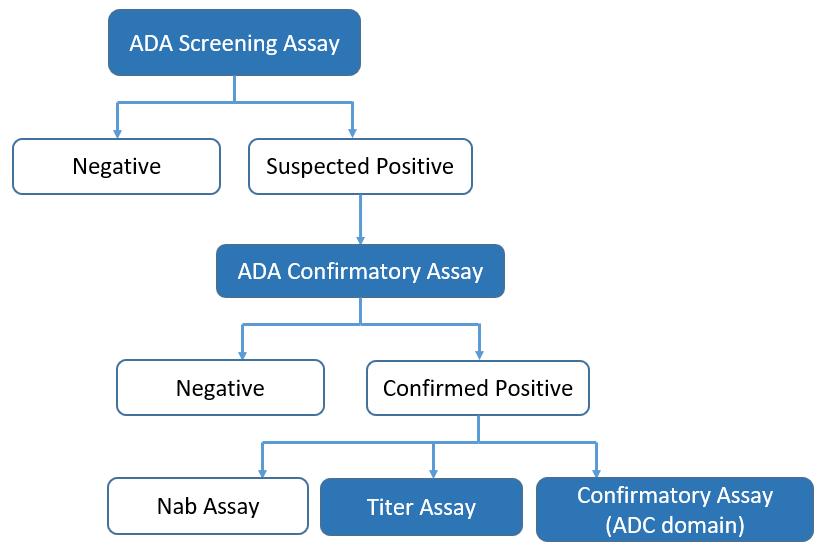
图6. ADA检测策略
为支持ADC药物的研发和临床试验,药明康德生物分析部已经开发了多款ADC药物的ADA的检测方法,包括单抗ADC和双抗ADC,在方法建立过程中常有的几个挑战如下:1)如果临床给药剂量比较高,生物样本中可能含有高浓度的游离受试药物,可以与捕获试剂/检测试剂竞争结合ADA,进而干扰ADA检测导致假阴性结果。因此,为提高药物耐受水平,可通过如酸解离、通过固相吸附除去过量的药物、延长孵育时间、以及稀释样本等多种方法解决。2)由于连接子或小分子毒素部分免疫原性弱,用ADC药物免疫制备的阳性对照抗体与之亲和力差,如果开展这部分的域特异性评价,需要额外制备亲和力高的阳性对照抗体。
对于抗药抗体(ADA)阳性的样本,通常需要分析中和抗体(Nab)。中和抗体是抗药抗体中的一类抗体,能够通过直接与药物作用结合位点结合,或者通过空间位阻的作用,使药物失去与其靶点结合的能力,从而封闭、中和药物的治疗活性。中和抗体的产生通常与血药浓度降低,药效降低,副作用的出现有着很强的关联性,因此对机体在使用生物药后产生的中和抗体检测是免疫原性检测中关键的一个部分。针对抗体部分的中和抗体(NAb)会阻碍ADC药物对细胞的杀伤作用,因而可以基于细胞的增殖凋亡实验来开发NAb的检测方法。基于ADC药物的作用机理和国内外法规及指导原则的要求[22-24],一般推荐使用基于细胞(Cell based)的检测方法来进行中和抗体的检测。
对于细胞平台的NAb检测,要选择合适的对于药物敏感的细胞株。例如,靶向HER2的ADC单抗药物,可以选择高表达HER2的人乳腺癌SK-BR-3细胞,药物能够与细胞上的HER2结合,并经内吞作用进入细胞,进而释放小分子毒素杀伤细胞;若样品中存在NAb,它能够与药物结合,阻断药物和细胞上的HER2的结合,使肿瘤细胞免于杀伤。用细胞活性试剂检测时,表现为荧光信号升高,具体检测原理见下图。
对于ADC双抗药物,需要基于药物分子的设计和药物的作用机理来制定相应的中和抗体检测策略。例如,药物需要同时结合两个靶点时才能发挥杀伤作用,则需要使用表达同时表达两个靶点的细胞株,开发一个Cell based NAb方法;若药物在分别结合单个靶点时就可以发挥作用可考虑使用分别表达两个靶点的细胞株,并开发两个Cell based NAb方法。
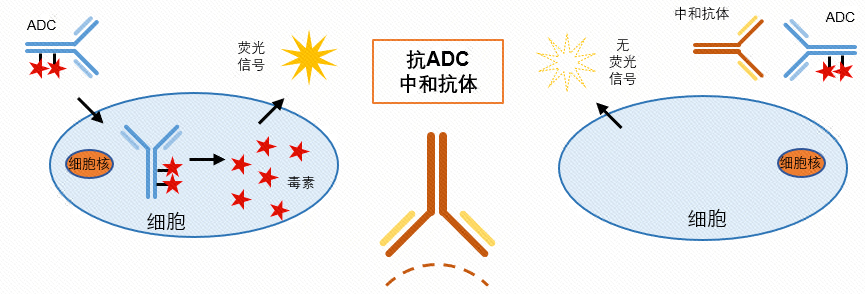
图7.NAb检测策略示意图
ADC药物的Nab生物分析方法建立过程中常遇到的可能有以下几个挑战:(1)由于临床中可能涉及多次给药,人体中存在高浓度的药物或药物与中和抗体的复合物,游离的药物会与细胞上的受体结合,干扰NAb检测,导致假阴性。因此,在方法开发过程中需要对药物耐受进行充分评估;一般可以采用固相萃取、磁珠提取或者热灭活[25]等方式来尝试提高药物耐受水平。(2)另外样品中也可能存在一定水平的靶点。可溶性靶点会和NAb竞争结合药物,干扰NAb检测,造成假阳性。因此,方法开发过程中也需要对靶点干扰水平进行考察。样本的前处理,如酸碱提取等,会影响样本的pH条件,进而影响细胞活性和实验的灵敏度。若ADC药物的linker不耐酸[25],样本的前处理受限等情况下,也可以选择非细胞平台的检测方法。
ADC药物由于自身的特殊结构和复杂的组分多样性,对生物分析带来了很多的挑战,开发准确而稳定的ADC生物分析方法对研究ADC药物的药代和药效特征,免疫原性和安全性都极其重要,能更好的帮助我们理解药物在体内的真实情况,更好的助力药物获批上市,ADC药物的生物分析对于检测实验室的整体要求也越来越高,ADC药物的临床生物分析方法还是基于NMPA、FDA、以及EMA等相关指导原,PK的检测一般包括总抗体,ADC和小分子毒素等,常用的分析方法平台包括LBA平台和LC-MS平台,一般总抗体和ADC的检测在LBA平台展开,小分子化合物的检测在LC-MS平台开展;近年来随着LC-MS技术的发展,运用LC-MS, LBA-LC-MS, HRMS等平台定量检测ADC分子的报道也越来越多。在LBA平台进行ADC的定量检测一般需要考虑DAR值敏感性、靶点干扰、小分子毒素带来的影响之外,也需要关注总抗体和ADC检测浓度之间的关系。在LC-MS平台进行小分子毒素的定量检测则需要关注检测的灵敏度以及待测物的稳定性等。
ADC药物的免疫原性评估包括抗药抗体ADA和中和抗体Nab的检测,ADC药物的ADA检测主要遵循分层级免疫原性分析策略,另外基于风险或产品特征,对确证为阳性的样本进一步开展域特异性评价。对于ADA的生物分析方法需要重点关注方法的药物耐受度和关键试剂的标记等。Nab的检测有基于细胞的中和抗体检测方法(cell-based analysis)和非基于细胞的中和抗体检测方法(non-cell-base analysis),监管机构(FDA)更推荐使用cell-based,它更接近反映体内的真实情况,难点是需要找到合适的细胞系,更长时间的开发、优化和验证,变异大,基质效应明显,干扰大。在难以获得相关细胞系,或者基质干扰无法解决,cell assay 的信号弱等情况下,可以选择non-cell-based analysis,该方法简单,快速,而且更稳健,灵敏度更高(可能)。与ADA分析不同的是,Nab分析的阳性抗体需要有明显的中和活性(单抗和多抗都可以)。
目前药明康德测试事业部临床生物分析团队已经开发并验证了多种符合GLP法规要求的ADC生物分析方法,经验包含Her2,Her3,Trop-2,Claudin 18.2,PSMA,CDH3,CD38等单双抗靶点,Payload包括像MMAE,MMAF,DM1,DM4,SN38,DXD等,也支持过上市ADC药物的临床分析工作;同时在LC-MS平台也开发了多种检测基质中ADC和抗体PK的临床生物分析方法,无论在LBA平台还是LC-MS平台都积累了丰富的ADC临床分析经验,可以帮助客户解决ADC药物在临床生物分析中遇到的各种挑战,加速药物获批上市。
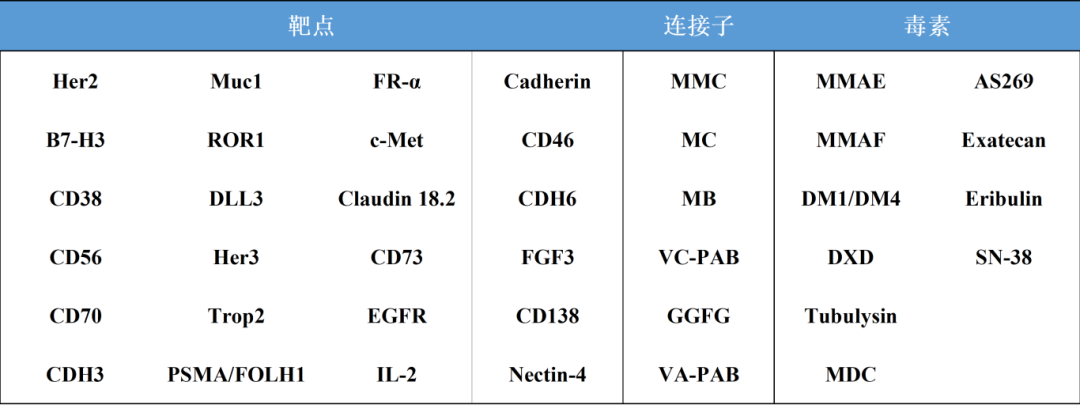
表2:药明康德测试事业部ADC临床检测经验(部分)
[1]https://www.cancer.org/research/cancer-facts-statistics/global-cancer-facts-and-figures.html
[2]Sung, Hyuna, et al. "Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries." CA:a cancer journal for clinicians 71.3 (2021): 209-249.
[3] Loadman, P. "Anticancer drug development." British journal of cancer 86.10 (2002): 1665-1666.
[4] Lindley, Celeste, et al. "Perception of chemotherapy side effects cancer versus noncancer patients." Cancer practice 7.2 (1999): 59-65.
[5] Lambert, John M., and Anna Berkenblit. "Antibody–drug conjugates for cancer treatment." Annual review of medicine 69.1 (2018): 191-207.
[6]Ethan Ennals For The Mail On Sunday. New breed of drug which reduces bladder cancer deaths could replace chemotherapy in other cases. At dailymail.co.uk (2021).
[7] Riccardi, Federico, et al. "A comprehensive overview on antibody-drug conjugates: from the conceptualization to cancer therapy." Frontiers in Pharmacology 14 (2023): 1274088.
[8] Fu, Zhiwen, et al. "Antibody drug conjugate: the “biological missile” for targeted cancer therapy." Signal transduction and targeted therapy 7.1 (2022): 93.
[9] Loganzo, Frank, Matthew Sung, and Hans-Peter Gerber. "Mechanisms of resistance to antibody–drug conjugates." Molecular cancer therapeutics 15.12 (2016): 2825-2834.
[10] Tsuchikama, Kyoji, et al. "Exploring the next generation of antibody–drug conjugates." Nature Reviews Clinical Oncology 21.3 (2024): 203-223.
[11] Gorovits, Boris, et al. "Bioanalysis of antibody–drug conjugates: american association of pharmaceutical scientists antibody–drug conjugate working group position paper." Bioanalysis 5.9 (2013): 997-1006.
[12]Clinical Pharmacology Considerations for Antibody-Drug Conjugates, Retrieved February 11, 2022.
Oncology 21.3 (2024): 203-223.
[13] Pandey, Renu, et al. "Stable isotope dilution LC-HRMS assay to determine free SN-38, total SN-38, and SN-38G in a tumor xenograft model after intravenous administration of antibody–drug conjugate (sacituzumab govitecan)." Analytical chemistry 92.1 (2019): 1260-1267.
[14] Xu, Ling, et al. "Simultaneous quantification of total antibody and antibody-conjugated drug for XMT-1522 in human plasma using immunocapture-liquid chromatography/mass spectrometry." Journal of Pharmaceutical and Biomedical Analysis 174 (2019): 441-449..
[15] Hyung, Suk-Joon, et al. "Multiplexed Quantitative Analysis of Antibody–Drug Conjugates with Labile CBI-Dimer Payloads In Vivo Using Immunoaffinity LC-MS/MS." Analytical Chemistry 94.2 (2021): 1158-1168.
[16] Surinder Kaur, Keyang Xu, Ola M Saad, Randall C Dere & Montserrat Carrasco-Triguero, Bioanalytical assay strategies for the development of antibody–drug conjugate biotherapeutics, Bioanalysis (2013) 5(2), 201–226.
[17] Lau, Uland Y., et al. "Lactone stabilization is not a necessary feature for antibody conjugates of camptothecins." Molecular Pharmaceutics 15.9 (2018): 4063-4072.
[18]Faria, Morse, et al. "Multiplex LC-MS/MS assays for clinical bioanalysis of MEDI4276, an antibody-drug conjugate of tubulysin analogue attached via cleavable linker to a biparatopic humanized antibody against HER-2." Antibodies 8.1 (2019): 11.
[19]Li, Chunze, et al. "Clinical pharmacology of vc-MMAE antibody–drug conjugates in cancer patients: learning from eight first-in-human Phase 1 studies." MAbs. Vol. 12. No. 1. Taylor & Francis, 2020.
[20] Clinical Pharmacology Considerations for Antibody-Drug Conjugates, Retrieved February 11, 2022.
[21] US FDA Guidance for Industry, Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection, 24 May 2022.
[22]药物免疫原性研究技术指导原则2021-03-25.
[23]USP 40 <1106.1> Immunogenicity Assays / General Information.
[24]Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection, FDA Guidance for Industry, Jan2019.
[25]Fiorotti, Corinna K. "Immunogenicity considerations for antibody–drug conjugates: A focus on neutralizing antibody assays." Bioanalysis 10.2 (2018): 65-70.
关于药明康德测试事业部生物分析部
药明康德生物分析部(Bioanalytical Services Department, BAS)成立于2005年,拥有全球高水平的中美一体化运营实验室,恪守行业高质量监管的标准,符合GLP和GCP运营管理要求,拥有完备的仪器平台,汇聚众多资深专家,旨在为全球客户提供全面的、专业的生物分析解决方案,包括但不限于临床前/临床质谱、免疫化学、分子/细胞分析及中心实验室一站式服务。实验室历年来多次通过中国国家药品监督管理局(NMPA,原CFDA)、美国食品药品监督管理局(FDA)、经济合作与发展组织(OECD)、欧洲药品管理局(EMA)、美国病理学家协会(CAP)、日本医药品医疗器械综合机构(PMDA)的体系和项目核查。对处于研发任一阶段的药物,生物分析部都能提供全方位的定量和分析服务。我们的团队拥有超过18年的行业经验,可以为化学药、生物药、寡核苷酸、基因和细胞治疗药物提供全面系统的生物分析解决方案,助力客户的药物成功申报IND、NDA和BLA。迄今为止,我们已经支持了全球3000多项临床试验,完成7000多个方法验证,每年可分析超过200万个样品。
关于药明康德测试事业部
药明康德测试事业部(Laboratory Testing Division, LTD),是全球药物研发和医疗器械全方位测试平台,提供世界高水平的一体化测试解决方案,赋能科学家把他们的理念转化成卓越的医疗健康产品,加速从科研到临床应用的转化,造福广大民众。
我们提供全球申报一体化服务,整合药学、药理学、药性评价、安全评价和生物分析,助力化合物获得IND批准,并实现下一个开发里程碑。